우리는 지금 mRNA 백신이라는 혁신의 시대에 살고 있습니다. 하지만 이 기술이 하루아침에 완성된 것이 아니라는 사실을 아는 분들은 많지 않죠. 1990년대부터 수많은 과학자가 RNA를 치료제로 쓰려 노력했지만, 항상 두 가지 거대한 벽에 부딪혔습니다. 첫째는 우리 몸의 면역 체계가 외부에서 들어온 RNA를 '침입자'로 간주해 격렬하게 공격한다는 것이었고, 둘째는 RNA 자체가 너무 불안정해 단백질을 제대로 만들어내기도 전에 파괴된다는 점이었어요.
이 절망적인 상황에서 돌파구를 마련한 것이 바로 카탈린 카리코(Katalin Karikó) 박사와 드류 와이스먼(Drew Weissman) 박사의 2008년 연구입니다. 그들은 '슈도유리딘'이라는 작은 분자의 변형이 mRNA의 운명을 바꿀 수 있음을 증명해냈죠. 오늘 저는 학습 노트에서 이 논문의 핵심 논리를 하나하나 짚어보려 합니다.
이 논문은 단순히 실험실에서 얻은 하나의 결과물이 아닙니다. 인류가 바이러스와의 전쟁에서 승리할 수 있게 해 준 가장 강력한 무기인 고효율, 저면역성 mRNA 벡터의 탄생을 알리는 신호탄이었습니다.
특히 이 논문은 체외에서 합성된 mRNA(IVT mRNA)가 가진 치명적인 한계였던 면역원성 문제를 어떻게 해결했는지, 그리고 단순히 면역 반응을 피하는 것을 넘어 어떻게 단백질 생산 능력을 비약적으로 향상시켰는지를 보여주는 드라마틱한 서사를 담고 있습니다. 슈도유리딘(Pseudouridine)이라는 낯선 분자가 어떻게 생명공학의 판도를 바꾸었는지, 지금부터 저와 함께 그 깊은 이야기 속으로 들어가 보시죠. 이 긴 여정을 마칠 때쯤이면 여러분은 mRNA 기술의 진정한 식견을 갖게 될 것입니다. 솔직히 말씀드리면, 이 논문을 제대로 이해하는 것만으로도 현대 생명공학의 절반을 이해하는 것이나 다름없거든요. 자, 그럼 인류를 구한 분자 생물학의 세계로 깊숙이 들어가 보실까요?
서론: 체외 합성 mRNA의 한계와 변형 뉴클레오사이드의 도입 배경
이 논문의 서론은 당시 유전자 치료 분야가 직면해 있던 거대한 장벽에 대한 이야기로 시작됩니다. 2000년대 초반까지만 해도 체외에서 전사된 mRNA, 즉 IVT mRNA를 치료 목적으로 사용하는 것은 거의 불가능에 가까운 도전이었습니다. 이론적으로는 mRNA를 세포에 넣어주면 부족한 단백질을 만들어내거나 백신 항원을 생산할 수 있어야 했지만, 실제 상황은 달랐습니다. 우리 몸, 특히 포유류의 세포는 외부에서 들어온 RNA를 자신의 유전 정보를 전달하는 메신저로 인식하는 것이 아니라, 침입한 바이러스의 유전 물질로 인식했기 때문입니다. 이것은 수십억 년에 걸친 진화의 결과로 획득된 아주 정교하고 강력한 방어 시스템입니다.
저자들은 서론에서 이러한 선천 면역 반응의 메커니즘을 상세히 언급합니다. 외부에서 주입된 RNA는 세포 내의 특정 수용체들, 특히 톨 유사 수용체(Toll-like Receptors, TLRs)인 TLR3, TLR7, TLR8 등에 의해 감지됩니다. 이 수용체들이 RNA를 감지하는 순간, 세포는 비상사태를 선포합니다. 인터페론과 같은 염증성 사이토카인을 대량으로 뿜어내고, 주변 세포들에게 바이러스가 침투했음을 알립니다. 더 치명적인 것은, 이러한 신호 전달 과정이 결국 단백질 번역 기구를 멈추게 만든다는 것입니다. 즉, 우리가 기껏 넣어준 mRNA가 단백질을 만들기도 전에 세포의 방어 기제에 의해 차단당하고, 심지어는 과도한 염증 반응으로 인해 숙주에게 해를 입힐 수도 있는 상황이었던 것입니다.
카리코 박사팀은 여기서 매우 독창적인 질문을 던집니다. 우리 몸속에 이미 존재하는 RNA들, 예를 들어 tRNA(전령 RNA)나 rRNA(리보솜 RNA)는 왜 면역 반응을 일으키지 않는 것일까? 이 질문이 바로 이 연구의 출발점입니다. 자연계에 존재하는 RNA, 특히 진핵생물의 RNA는 전사 후에 다양한 화학적 변형을 거칩니다. 메틸기가 붙거나 구조가 살짝 바뀌는 등의 변형이 일어나는데, 연구진은 이러한 자연적인 뉴클레오사이드 변형이 RNA가 면역 시스템의 감시망을 피하게 해주는 '신분증' 역할을 할 것이라고 가설을 세웠습니다.
논문에서는 이러한 배경 지식을 바탕으로, RNA를 구성하는 기본 단위인 뉴클레오사이드에 인위적인 변형을 가했을 때 면역원성과 번역 효율이 어떻게 달라지는지를 탐구하겠다고 밝힙니다. 특히 그들은 슈도유리딘(Pseudouridine, Ψ )이라는 특정 변형에 주목했습니다. 슈도유리딘은 RNA에서 가장 흔하게 발견되는 변형 중 하나로, 유리딘의 이성질체입니다. 화학식은 같지만 구조가 다른 이 작은 차이가 생물학적으로 어떤 거대한 나비효과를 불러일으키는지 규명하는 것이 이 논문의 핵심 목표입니다.
서론에서 저자들은 기존의 유전자 전달 벡터들, 예를 들어 바이러스 벡터나 DNA 플라스미드가 가진 문제점도 지적합니다. 바이러스 벡터는 유전체 삽입 변이의 위험이 있고, DNA는 핵 안으로 들어가야만 작동할 수 있다는 공간적 제약이 있습니다. 반면 mRNA는 세포질에서 작용하므로 유전체 통합의 우려가 없고 훨씬 안전합니다. 다만 앞서 말한 면역원성과 불안정성이 문제였던 것이죠. 이 논문은 바로 그 마지막 퍼즐 조각을 맞추기 위한 여정의 기록입니다. 저자들은 이 연구를 통해 변형된 뉴클레오사이드, 특히 슈도유리딘을 포함한 mRNA가 면역 반응을 획기적으로 줄일 뿐만 아니라, 기존에는 상상할 수 없었던 수준의 높은 단백질 번역 효율과 생물학적 안정성을 제공한다는 것을 입증하고자 합니다. DNA와 달리 mRNA는 세포핵 안으로 들어갈 필요가 없고, 유전체에 삽입될 위험이 없어 안전성이 높다는 점을 강조하죠. 하지만 실제 임상 적용을 가로막았던 가장 큰 문제는 바로 선천 면역 시스템의 활성화였습니다.
이 서론 부분이 중요한 이유는 단순히 연구의 목적을 밝히는 것을 넘어, 왜 우리가 '변형(Modification)'에 주목해야 하는지에 대한 당위성을 부여하기 때문입니다. 자연을 모방함으로써 자연의 방어막을 뚫는다는 이 우아한 접근 방식은 이후 생명공학 연구에 지대한 영향을 미치게 됩니다. 이제 우리는 저자들이 이 가설을 증명하기 위해 어떤 치밀한 실험을 준비했는지, 그 방법론적 접근을 살펴볼 준비가 되었습니다.
우리 몸은 Toll-like Receptor(TLR)라는 센서를 통해 외부 바이러스 RNA를 감지합니다. 특히 TLR3, TLR7, TLR8은 mRNA의 특정 염기 서열과 구조를 인식하여 인터페론(IFN)과 같은 염증 유발 물질을 쏟아내게 하죠. 이 현상 때문에 초기 RNA 치료제 실험들은 단백질을 만들기도 전에 심한 염증 반응으로 실패하기 일쑤였습니다.
카리코와 와이스먼은 이 문제의 해답을 '자연계에 존재하는 변형 염기'에서 찾았습니다. 우리 몸의 세포 안에 원래 존재하는 tRNA나 rRNA에는 다양한 변형 염기가 포함되어 있는데, 이들은 면역 반응을 일으키지 않는다는 점에 주목한 것이죠. 논문은 바로 이 지점에서 시작됩니다. "만약 mRNA를 만들 때 인위적으로 이 변형 염기를 넣는다면, 면역 시스템을 속일 수 있지 않을까?"라는 담대한 질문을 던진 것입니다.
결과 분석 1: 슈도유리딘의 면역원성 제거와 염증 반응 억제 효과
이제 논문의 본론인 결과(Results) 섹션으로 들어가 보겠습니다. 첫 번째로 다룰 소주제는 바로 면역원성(Immunogenicity)에 관한 것입니다. 앞서 서론에서 언급했듯이, 일반적인 IVT mRNA는 세포에 들어가는 순간 강력한 면역 반응을 유발합니다. 저자들은 이를 정량적으로 확인하고, 변형된 뉴클레오사이드가 이 반응을 얼마나 억제할 수 있는지 비교 실험을 진행했습니다.
연구진은 먼저 다양한 종류의 변형된 뉴클레오사이드를 준비했습니다. 여기에는 5-메틸사이티딘(m5C), N6-메틸아데노신(m6A), 5-메틸유리딘(m5U), 2-티오유리딘(s2U), 그리고 오늘의 주인공인 슈도유리딘( Ψ )이 포함되었습니다. 그들은 이들을 각각 포함하여 체외에서 mRNA를 합성한 뒤, 인간의 수지상 세포(Dendritic Cells)에 처리했습니다. 수지상 세포는 우리 몸의 면역 시스템에서 파수꾼 역할을 하는 세포로, 외부 물질에 대해 매우 민감하게 반응합니다.
실험 결과는 실로 놀라웠습니다. 변형되지 않은 일반 유리딘(Uridine)을 포함한 mRNA를 처리한 세포에서는 예상대로 엄청난 양의 염증성 사이토카인, 특히 종양괴사인자-알파(TNF-α)와 인터페론-알파(IFN-α)가 분비되었습니다. 이것은 세포가 해당 RNA를 위험한 바이러스로 인식했다는 명백한 증거였습니다. 반면, 변형된 뉴클레오사이드를 포함한 mRNA, 그중에서도 슈도유리딘으로 유리딘을 전면 교체한 mRNA를 처리한 그룹에서는 이러한 사이토카인 분비가 거의 관찰되지 않았습니다. 수치는 거의 배경 수준(background level)으로 떨어져 있었는데, 이는 세포의 면역 센서들이 슈도유리딘이 포함된 mRNA를 외부 침입자로 인식하지 못했거나, 인식했더라도 위험 신호를 보내지 않았음을 의미합니다.
논문에서는 이 현상을 TLR(Toll-like Receptor)의 관점에서 심도 있게 분석합니다. 저자들은 HEK293 세포에 특정 TLR(TLR3, TLR7, TLR8)만을 발현시킨 뒤 실험을 진행하여, 슈도유리딘이 포함된 RNA가 이들 수용체의 활성화를 피한다는 것을 증명했습니다. 일반적으로 RNA는 TLR7이나 TLR8에 결합하여 면역 신호를 유발하는데, RNA 사슬 내의 유리딘이 슈도유리딘으로 바뀌면서 수용체와의 결합력이나 인식 패턴이 달라져 면역 회피가 가능해진 것입니다. 이는 구조 생물학적인 관점에서도 매우 흥미로운 발견입니다. 슈도유리딘은 유리딘과 달리 C-C 결합으로 당과 염기가 연결되어 있어(유리딘은 C-N 결합), 수소 결합을 형성할 수 있는 능력이 더 뛰어납니다. 이러한 미세한 구조적 차이가 RNA의 2차 구조를 더 단단하게 만들고, 결과적으로 면역 수용체의 탐지를 무력화시킨 것입니다.
또한 저자들은 슈도유리딘 외에도 m5C(5-메틸사이티딘)와 같은 다른 변형들도 면역 반응을 줄이는 데 효과가 있음을 보였지만, 슈도유리딘의 효과가 가장 탁월하거나 혹은 m5C와 조합되었을 때 시너지를 낸다는 점을 강조했습니다. 이 데이터는 왜 이후의 코로나19 백신들이 슈도유리딘(정확히는 N1-메틸슈도유리딘이라는 파생형)을 선택하게 되었는지를 설명해 주는 결정적인 근거가 됩니다. 만약 이 연구가 없었다면, 우리는 mRNA 백신을 맞을 때마다 극심한 전신 염증 반응과 고열에 시달려야 했을지도 모릅니다. 아니, 애초에 임상 시험을 통과하지 못했을 것입니다.
이 섹션에서 우리가 주목해야 할 또 다른 포인트는 '순도'에 대한 저자들의 집요함입니다. 그들은 단순히 변형된 RNA를 만드는 것에 그치지 않고, 합성 과정에서 생길 수 있는 불순물인 이중가닥 RNA(dsRNA)를 제거하는 것이 면역원성을 낮추는 데 중요하다는 점도 놓치지 않았습니다. 비록 이 논문의 메인 포커스는 슈도유리딘이라는 화학적 변형에 맞춰져 있지만, 고품질의 RNA를 정제하는 과정 또한 면역 회피에 기여한다는 사실을 암시하고 있습니다.
논문의 Figure 1a를 보면 이들의 화학적 구조가 명확히 제시되어 있는데, 이는 기존의 유리딘(U) 구조를 미세하게 변형한 형태입니다.
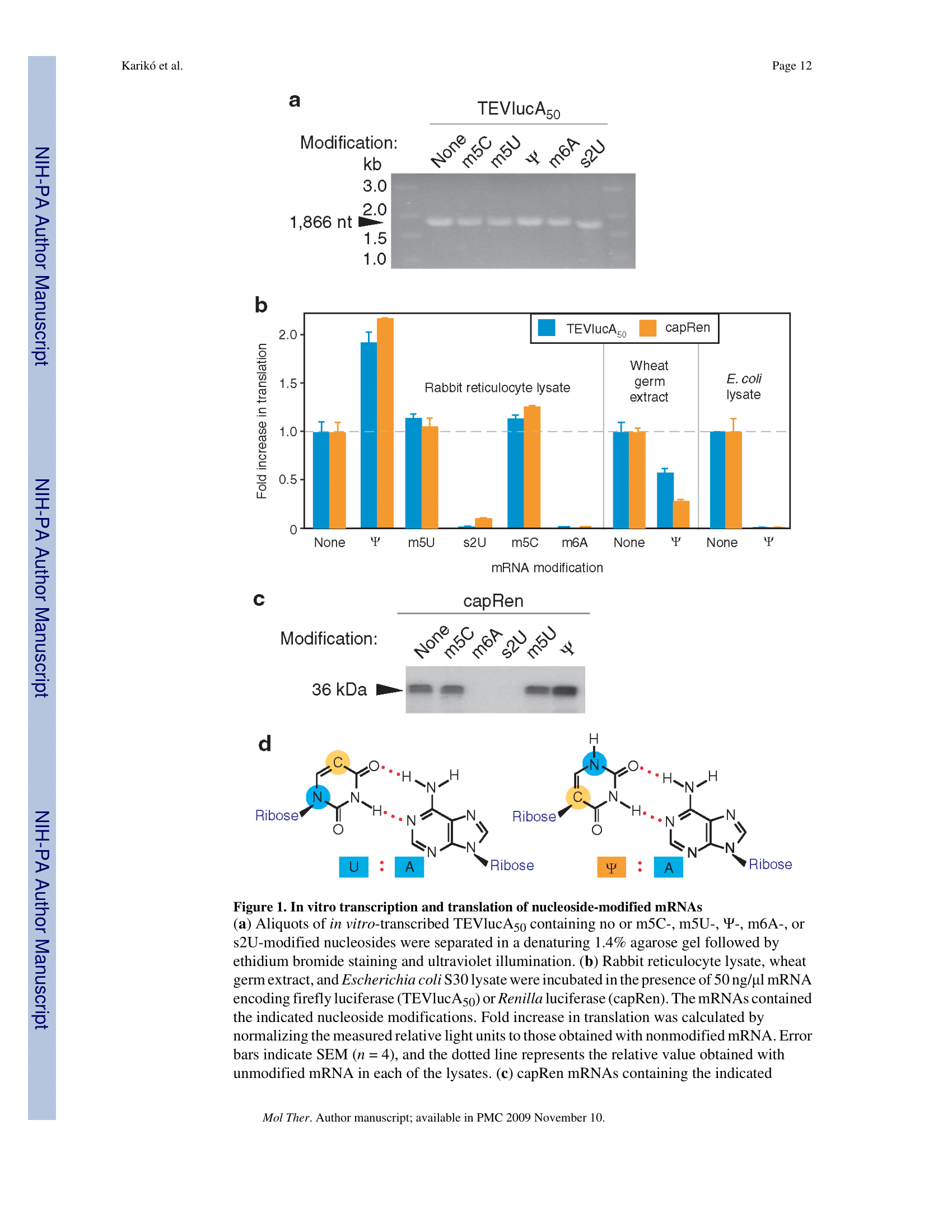
변형 염기별 번역 효율 비교 (Rabbit Reticulocyte Lysates)
| 변형 염기 종류 | 번역 효율 결과 | 분석 비고 |
|---|---|---|
| 슈도유리딘 ( Ψ ) | 비변형 대비 2배 이상 증가 | 독보적인 성능, 안정성 확보 |
| m5U / m5C | 비변형과 유사한 수준 | 면역 회피에는 도움되나 효율은 보통 |
| s2U / m6A | 번역 효율 급격히 저하 | 리보솜과의 결합력 문제 발생 |
여기서 정말 놀라운 발견이 일어납니다. 당시 과학계의 통념은 "염기를 변형하면 리보솜이 인식하지 못해 단백질 합성이 잘 안 될 것"이라는 것이었습니다. 하지만 슈도유리딘( Ψ )이 들어간 mRNA는 오히려 비변형 mRNA보다 더 많은 단백질을 만들어냈습니다. 저자들도 이 결과에 상당히 놀랐다고 논문에 기술하고 있죠. 이는 슈도유리딘이 단순한 면역 회피를 넘어, mRNA의 구조적 안정성을 높여 리보솜이 더 원활하게 일을 할 수 있도록 돕는다는 사실을 시사합니다.
모든 변형 염기가 좋은 것은 아닙니다. m6A와 같은 변형은 번역을 거의 완전히 중단시켰습니다. 즉, 아데노신 자리에 메틸기가 붙으면 리보솜의 움직임을 물리적으로 방해하게 되는 것이죠. 따라서 슈도유리딘의 선택은 단순한 우연이 아닌 정교한 스크리닝의 결과였습니다.
결론적으로, 이 파트의 데이터는 슈도유리딘이 포함된 mRNA가 '스텔스 전투기'와 같다는 것을 보여줍니다. 적의 레이더(면역 시스템)에 걸리지 않고 목표 지점(세포질)까지 안전하게 침투할 수 있는 능력을 갖추게 된 것입니다. 하지만 침투만 한다고 끝이 아닙니다. 폭탄을 투하(단백질 생산)해야 작전이 성공하겠죠? 다음 섹션에서는 바로 이 폭탄 투하 능력, 즉 번역 효율에 대한 놀라운 결과들을 살펴보겠습니다.
결과 분석 2: 번역 용량의 증가와 단백질 생산 효율의 극대화
면역 반응을 피하는 것만으로도 충분히 훌륭한 성과였겠지만, 카리코 박사팀이 발견한 더 큰 보물은 바로 '번역 용량(Translational Capacity)'의 비약적인 증가였습니다. 논문의 제목에서도 강조하고 있듯이, 슈도유리딘이 포함된 mRNA는 단순히 안전한 벡터가 아니라, '우월한(Superior)' 벡터입니다. 이 섹션에서는 그 우월함이 구체적으로 어떤 데이터로 증명되었는지 살펴보겠습니다.
연구진은 반딧불이 루시퍼라아제(Luciferase) 유전자를 리포터로 사용하여, 세포 내에서 실제로 얼마나 많은 단백질이 만들어지는지를 빛의 세기로 측정했습니다. 실험 설계는 매우 직관적이었습니다. 동일한 양의 일반 mRNA와 슈도유리딘 mRNA(Ψ-mRNA) 를 세포에 주입하고, 시간 경과에 따른 발광 정도를 비교한 것입니다. 결과는 연구진조차 예상치 못했을 만큼 극적이었습니다. Ψ-mRNA 를 주입한 세포에서는 일반 mRNA를 주입한 세포에 비해 수십 배에서 최대 수백 배에 달하는 더 많은 단백질이 생산되었습니다.
이것은 단순히 '조금 더 좋다'의 수준을 넘어선 결과였습니다. 도대체 왜 이런 일이 벌어진 것일까요? 논문에서는 그 원인을 규명하기 위해 RNA 의존성 단백질 키나아제(PKR, Protein Kinase R)에 주목합니다. PKR은 세포가 바이러스 감염을 방어하기 위해 사용하는 또 다른 중요한 센서입니다. PKR이 활성화되면 진핵생물 번역 개시 인자인 eIF2α(eukaryotic Initiation Factor 2 alpha)를 인산화시킵니다. eIF2α가 인산화되면 단백질 번역 과정이 멈춰버립니다. 즉, 세포는 바이러스가 들어왔다고 판단되면 자신의 공장을 셧다운 시켜버리는 것입니다. 바이러스가 복제하지 못하게 하려는 자폭 전략인 셈입니다.
일반적인 IVT mRNA는 세포 내에서 이 PKR을 강력하게 활성화시킵니다. 따라서 mRNA가 세포 안으로 들어갔다 하더라도, PKR이 작동하여 번역 기구를 멈춰 세우기 때문에 단백질이 제대로 만들어지지 않습니다. 하지만 연구진은 슈도유리딘이 포함된 mRNA는 PKR을 활성화시키지 않는다는 사실을 밝혀냈습니다. 이는 웨스턴 블롯(Western Blot) 분석을 통해 명확히 입증되었습니다. 일반 mRNA를 처리한 세포에서는 인산화된 eIF2α의 밴드가 진하게 나타난 반면, Ψ-mRNA를 처리한 세포에서는 인산화된 eIF2α가 거의 검출되지 않았습니다. 이 결과가 시사하는 바는 매우 큽니다. Ψ-mRNA는 세포의 ‘번역 차단 시스템’을 우회할 수 있다는 것입니다. 공장 가동이 멈추지 않으니, mRNA가 존재하는 동안 지속적으로 단백질을 찍어낼 수 있게 된 것입니다. 더욱이 슈도유리딘은 RNA의 2차 구조를 안정화시켜 리보솜(Ribosome)이 RNA를 더 잘 읽을 수 있게 도와주는 효과도 있는 것으로 추정됩니다. 이 모든 요인이 합쳐져서 폭발적인 단백질 생산량 증가로 이어진 것입니다.
또한 저자들은 세포의 종류에 따라 번역 효율의 증가 폭이 다르다는 것도 확인했습니다. 특히 번역 활성이 높고 면역 반응에 민감한 세포일수록 Ψ-mRNA 의 효과가 더욱 두드러졌습니다. 이는 임상적 응용 측면에서 매우 중요한 정보입니다. 우리가 치료하고자 하는 대부분의 질병 표적 세포들은 생체 내에서 활발하게 활동하는 세포들이기 때문입니다.
이 섹션의 논의를 통해 우리는 mRNA 치료제가 성공하기 위해서는 단순히 mRNA를 넣어주는 것만으로는 부족하다는 것을 깨닫게 됩니다. 세포가 그 mRNA를 '자신의 것'으로 받아들이고, 기꺼이 번역 기구를 빌려주도록 만들어야 합니다. 슈도유리딘은 바로 그 허가증 역할을 했습니다. PKR의 감시를 피하고 eIF2α의 인산화를 막음으로써, 세포의 번역 공장을 풀가동시키는 열쇠가 된 것입니다. 이 발견이야말로 오늘날 우리가 수십 억 회분의 백신을 생산하고 접종할 수 있게 만든, 생산성 혁명의 근본적인 원리라고 할 수 있습니다.
실험실 환경에서의 성공을 넘어, 연구진은 실제 살아있는 세포(293세포, 수지상세포 등)에서 이 mRNA들이 어떻게 작동하는지 확인했습니다. 결과는 더욱 압도적이었습니다. 슈도유리딘이 포함된 mRNA는 비변형 mRNA에 비해 약 10배나 높은 단백질 생성 효율을 보여주었습니다. (Figure 2a 참조)
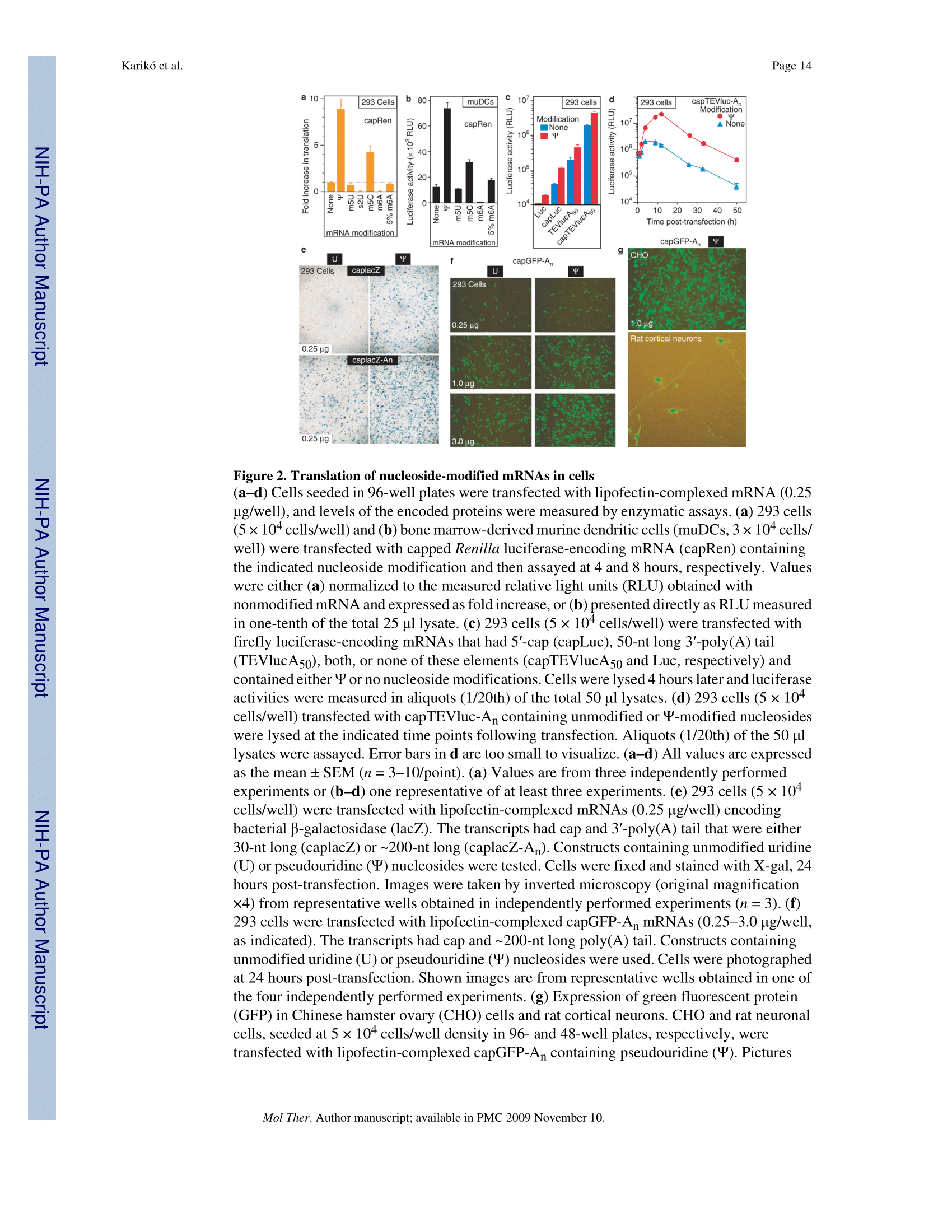
이러한 현상이 나타나는 이유에 대해 저자들은 여러 가지 가설을 검증했습니다. 단순히 캡(Cap) 구조나 폴리(A) 꼬리의 영향인지를 확인하기 위해 다양한 구조적 변수를 통제했지만, 슈도유리딘에 의한 효율 증대는 독립적으로 발생했습니다. "그니까요, 이 슈도유리딘이라는 녀석은 mRNA를 아주 '단단하고 효율적인 기계'로 만들어주는 셈이에요."라고 표현할 수 있겠네요.
번역 효율 증대의 분자 생물학적 메커니즘
- RNA 이차 구조의 안정화: 슈도유리딘은 유리딘보다 염기 적층(Base stacking) 효과가 강해 RNA 사슬이 더 안정적으로 유지됩니다.
- 분해 효소 저항성: 세포 내 RNase와 같은 분해 효소들이 변형된 염기를 잘 인식하지 못해 mRNA의 수명이 길어집니다.
- 리보솜 occupancy 증가: 안정된 구조 덕분에 더 많은 리보솜이 하나의 mRNA에 달라붙어 동시에 단백질을 찍어낼 수 있게 됩니다.
특히 흥미로운 점은 수지상세포(Dendritic Cells)에서의 결과입니다. 수지상세포는 우리 몸의 면역 사령관 같은 역할을 하는데, 여기서 단백질 합성이 잘 된다는 것은 백신으로서의 가능성이 무궁무진하다는 뜻이거든요. 슈도유리딘 mRNA는 면역 세포를 화나게 하지 않으면서도, 그들 내부에서 항원 단백질을 대량으로 생산해내는 '트로이 목마'와 같은 역할을 완벽히 수행했습니다.
결과 분석 3: 생물학적 안정성과 반감기의 연장
우수한 벡터가 갖추어야 할 세 번째 조건은 바로 '안정성(Stability)'입니다. 아무리 면역 반응이 없고 단백질을 잘 만든다고 해도, 세포 내에 들어가자마자 분해되어 사라진다면 치료 효과를 기대하기 어렵습니다. mRNA는 본래 DNA에 비해 매우 불안정한 분자입니다. 우리 몸 곳곳에는 RNA를 분해하는 효소인 RNase가 득실거리기 때문입니다. 이 논문은 슈도유리딘 도입이 mRNA의 물리적, 생물학적 안정성에 미치는 영향에 대해서도 심도 있는 분석을 제공합니다.
저자들은 mRNA의 반감기를 측정하는 실험을 수행했습니다. 세포에 mRNA를 주입한 후, 일정 시간이 지날 때마다 남아있는 mRNA의 양과 생산되는 단백질의 양을 추적했습니다. 일반 유리딘으로 구성된 mRNA는 주입 후 몇 시간 이내에 급격히 분해되거나 기능이 저하되는 패턴을 보였습니다. 이는 세포 내 RNase에 의한 공격과 앞서 언급한 면역 반응에 의한 불안정화가 복합적으로 작용한 결과입니다.
반면, 슈도유리딘이 포함된 Ψ-mRNA 는 훨씬 더 긴 반감기를 보여주었습니다. 이는 두 가지 측면에서 설명될 수 있습니다. 첫째, 슈도유리딘의 화학적 구조가 RNase에 대한 저항성을 부여합니다. 슈도유리딘은 염기 겹침(Base Stacking)을 강화하여 RNA의 구조를 더 단단하고 컴팩트하게 만듭니다. 이렇게 단단하게 뭉친 구조는 효소가 접근하여 절단하기 어렵게 만듭니다. 논문에서는 이러한 구조적 안정성이 생체 내 환경에서 mRNA가 더 오래 살아남을 수 있게 하는 중요한 요인임을 시사합니다.
둘째, 안정성의 증가는 번역 효율의 증가와도 밀접하게 연결되어 있습니다. 일반적으로 mRNA는 번역이 활발하게 일어날 때, 즉 리보솜이 붙어 있을 때 분해 효소로부터 보호를 받습니다. 앞서 보았듯이 Ψ-mRNA 는 PKR을 활성화시키지 않아 번역이 멈추지 않고 지속됩니다. 따라서 리보솜들이 mRNA 위에 빽빽하게 붙어 있는 상태(Polysome)를 유지할 가능성이 높고, 이것이 물리적인 방패막이 되어 mRNA를 분해로부터 지켜주는 선순환 구조를 만드는 것입니다.
논문에서는 이러한 체외(in vitro) 결과를 바탕으로 생체 내(in vivo) 실험으로 범위를 확장합니다. 쥐(mice)에게 복합체로 감싼 Ψ-mRNA 를 정맥 주사한 후, 비장(spleen) 등 주요 장기에서의 단백질 발현을 확인했습니다. 그 결과, 생체 내에서도 Ψ-mRNA 는 일반 mRNA에 비해 월등히 높은 수준의 단백질을 생산했으며, 그 효과가 더 오래 지속됨을 확인했습니다. 특히 쥐에게 주입했을 때 전신적인 염증 반응 지표들이 현저히 낮게 유지되면서도 표적 단백질은 고농도로 검출되었다는 점은, 이 기술이 실제 의약품으로 개발될 수 있는 가능성을 강력하게 시사하는 대목입니다.
생물학적 안정성은 약물의 투여 빈도와 용량을 결정하는 결정적인 요소입니다. mRNA가 체내에서 더 오래 버틸 수 있다면, 환자에게 더 적은 양을 투여해도 충분한 치료 효과를 낼 수 있고, 주사 맞는 횟수도 줄일 수 있습니다. 카리코 박사의 이 논문은 슈도유리딘이 mRNA를 '잠깐 스쳐 지나가는 메시지'에서 '지속적이고 강력한 약물'로 변모시켰음을 입증했습니다. 이는 RNA가 가진 태생적 한계인 불안정성을 화학적 수식을 통해 극복한 훌륭한 사례로 기록됩니다.
그렇다면 이 번역 효율의 차이가 혹시 세포의 면역 반응 때문에 생기는 2차적인 결과는 아닐까요? 예를 들어, 비변형 mRNA가 세포를 공격하게 해서 세포가 단백질 합성을 스스로 중단한 것일 수도 있잖아요. 이를 확인하기 위해 연구팀은 RIG-I라는 또 다른 면역 센서가 결여된 마우스 배아 섬유아세포(MEFs)를 사용해 실험을 진행했습니다.
결과는 명확했습니다. 면역 센서가 있든 없든, 슈도유리딘 mRNA는 비변형 mRNA보다 더 높은 번역 효율을 유지했습니다. (Figure 3 참조) 이는 번역 효율 증대가 단순히 면역 반응이 없어서 나타나는 반사이익이 아니라, 슈도유리딘 자체가 가진 내재적인 생화학적 특성임을 못 박는 중요한 증거가 되었습니다.

RIG-I는 주로 5'-트리포스페이트 구조를 인식합니다. 저자들은 캡(Cap) 구조를 씌워 RIG-I 활성화를 최소화한 상태에서도 슈도유리딘의 우월함을 증명해냈습니다. 이는 슈도유리딘 mRNA 기술이 매우 정교한 수준에서 설계되었음을 보여줍니다.
결과 4: Ψ(슈도유리딘)를 포함한 mRNA의 생쥐에서의 효율적인 번역
이제 가장 결정적인 단계입니다. 실제 살아있는 동물인 마우스(Mice)에게 이 mRNA를 주입했을 때 어떤 일이 벌어질까요? 저자들은 루시퍼레이즈(Luciferase, 반딧불이 빛을 내는 효소) 단백질을 만드는 mRNA를 꼬리 정맥을 통해 주입했습니다.
🔢 In vivo 실험 데이터 요약 카드
비변형 mRNA 대비 슈도유리딘 변형 mRNA의 성능 측정값
Figure 4c와 4e의 그래프를 보면 전율이 느껴집니다. 주입 1시간 만에 슈도유리딘 mRNA를 맞은 쥐의 비장(Spleen)에서는 강력한 빛 신호가 감지되었습니다. 반면 비변형 mRNA를 맞은 쥐는 신호가 아주 미미했죠. 시간이 흐를수록 격차는 더 벌어졌습니다. 주입 24시간 후에도 슈도유리딘 mRNA는 여전히 단백질을 만들어내고 있었지만, 비변형 mRNA는 이미 모두 분해되어 흔적조차 찾기 힘들었습니다. "솔직히 말해서, 0.3마이크로그램이라는 아주 적은 양으로 이렇게 높은 단백질 수치를 얻을 수 있다는 건 당시로서는 마법 같은 일이었어요." 저자들은 노던 블롯(Northern Blot) 분석을 통해 실제로 조직 내에 남아있는 RNA의 양을 측정했고, 슈도유리딘 mRNA가 비변형 RNA보다 훨씬 오랫동안 파괴되지 않고 버티고 있음을 확인했습니다. (Figure 4d) 이것이 바로 생물학적 안정성(Biological Stability)의 승리였습니다.

결과 5: Ψ(슈도유리딘)로 변형된 mRNA는 생쥐에서 면역반응을 유발하지 않는다
단백질을 많이 만드는 것도 중요하지만, 염증 반응이 없어야 진짜 약으로 쓸 수 있겠죠? 연구진은 쥐의 혈청을 채취해 대표적인 염증성 사이토카인인 인터페론-알파(IFN-α)와 종양괴사인자(TNF-α)의 농도를 측정했습니다.
결과는 예상대로였습니다. 비변형 mRNA를 주입받은 쥐들은 혈청 내 IFN-α 수치가 치솟으며 심각한 면역 반응을 보였지만, 슈도유리딘 mRNA를 맞은 쥐들은 아무런 염증 반응도 나타나지 않았습니다. (Figure 4f) 심지어 비변형 RNA를 주입한 쥐의 비장에서는 TNF-α mRNA 수치까지 증가한 것이 확인되었습니다. 이는 슈도유리딘이 면역 체계의 감시망을 완벽하게 통과하는 '투명 망토' 역할을 하고 있음을 입증한 것입니다.

여기서 잠깐! 왜 비변형 RNA는 위험했을까요?
우리 몸의 수지상세포는 외부 RNA의 유리딘(U) 서열을 포식한 뒤, 이를 TLR7/8로 전달합니다. 그러면 세포는 "적군이 침입했다!"고 판단하여 사이토카인 폭풍을 일으키죠. 슈도유리딘은 U와 화학적으로 유사하지만 수소 결합 위치가 살짝 달라 TLR 센서에 걸리지 않습니다. 참 영리한 전략이죠?
논의: 현대 의학의 새로운 지평을 열다
논문의 논의(DISCUSSION) 섹션에서 저자들은 이 발견의 함의를 매우 열정적으로 서술합니다. 그들은 슈도유리딘 mRNA 기술이 단순한 학술적 발견을 넘어, 유전자 치료와 백신 개발의 '게임 체인저'가 될 것임을 예견했습니다.
논문에서 강조한 mRNA의 7가지 우월성
- 안전성: 유전체 삽입 위험이 없음.
- 낮은 면역원성: 슈도유리딘 사용 시 염증 반응 차단.
- 효율성: DNA와 달리 비증식성 세포(Primary cells)에서도 작용.
- 신속성: 세포질 도달 즉시 단백질 생성 시작.
- 용량 조절: mRNA 양에 비례해 단백질 양 조절 가능.
- 무제한성: 크기 제한 없이 매우 긴 단백질 코드도 전달 가능.
- 생산성: 대규모 바이오리액터에서 연속 생산 가능.
논문은 마지막으로 "이 기술이 바이러스 백신뿐만 아니라 결핍된 단백질을 보충해 주는 유전자 대체 요법(Gene replacement therapy)에도 효과적일 것"이라고 결론짓습니다. 2008년의 이 예언은 2020년 코로나19 팬데믹 상황에서 수십억 명의 생명을 구하는 백신으로 실현되었고, 현재는 암 치료 백신과 희귀 질환 치료제로 그 영역을 넓히고 있습니다.
종합 고찰: mRNA 기술의 미래를 연 기념비적 성과
논문의 고찰(Discussion) 섹션에서 저자들은 자신들의 발견이 갖는 의미를 종합적으로 정리하며, 이것이 앞으로 유전자 치료와 백신 개발에 어떤 변화를 가져올지 예견합니다. 저자들은 슈도유리딘의 도입이 단순히 면역원성을 없애는 '소극적'인 해결책이 아니라, 번역 용량과 안정성을 동시에 높이는 '적극적'인 성능 향상 전략임을 강조합니다.
이 논문이 발표된 2008년 당시에는 아직 CRISPR 유전자 가위 기술이나 현재의 지질 나노입자(LNP) 기술이 완벽하게 정립되지 않았던 시기입니다. 그럼에도 불구하고 저자들은 변형된 mRNA가 줄기세포 유도, 암 백신, 감염병 백신, 단백질 보충 요법 등 다양한 분야에 응용될 수 있음을 꿰뚫어 보았습니다. 그들은 자연계가 진화 과정에서 선택한 'RNA 변형'이라는 지혜를 인간이 모방함으로써, 생물학적 장벽을 극복할 수 있다는 철학적인 통찰까지 보여줍니다.
특히 고찰 부분에서 흥미로운 점은, 저자들이 RNA 센서들(TLR, PKR 등)의 기작과 RNA 변형 사이의 관계를 매우 정교하게 연결 짓는다는 것입니다. 그들은 자연적인 RNA(박테리아 RNA와 포유류 RNA)의 차이가 변형의 유무에 있다는 점을 상기시키며, 우리 몸의 면역 체계가 '자기(Self)'와 '비자기(Non-self)'를 구별하는 기준이 염기 서열뿐만 아니라 뉴클레오사이드의 화학적 상태에도 있음을 명확히 했습니다. 이는 면역학적으로도 매우 중요한 발견으로, 이후 면역학 교과서의 내용을 다시 쓰게 만드는 계기가 되었습니다.
또한 저자들은 이 기술의 안전성에 대해서도 자신감을 보였습니다. 바이러스 벡터를 사용하지 않기 때문에 유전체 변형의 우려가 없고, 필요한 시간 동안만 단백질을 만들고 사라지는 mRNA의 특성이야말로 이상적인 치료제의 조건에 부합한다고 주장합니다. 그리고 슈도유리딘 도입으로 인해 생기는 안정성 증가는 이러한 mRNA의 장점을 극대화하여, 임상 적용의 문턱을 넘게 해 줄 것이라고 예측했습니다.
실제로 이 논문이 나온 지 12년 후, 전 세계는 코로나19 팬데믹이라는 초유의 사태를 맞이했고, 카리코 박사의 이 연구 결과는 화이자-바이오엔텍과 모더나의 백신 개발에 핵심 원천 기술로 사용되었습니다. 인류를 구원한 기술이 바로 이 2008년 논문의 표와 그래프 속에 숨어 있었던 것입니다. 저자들이 고찰에서 꿈꾸었던 '우월한 비면역원성 벡터(Superior nonimmunogenic vector)'는 현실이 되어 수십억 명의 팔뚝에 주입되었습니다.
결론적으로 이 논문은 생화학, 면역학, 분자생물학이 만나는 교차점에서 탄생한 걸작입니다. 뉴클레오사이드 하나를 바꾸는 작은 변화가 세포 내 신호 전달 체계, 단백질 합성 기구, 그리고 면역 시스템 전체에 걸쳐 얼마나 거대한 긍정적 효과를 불러올 수 있는지를 보여주었습니다. 저는 이 논문을 '현대 의학의 로제타스톤'이라고 부르고 싶습니다. 우리가 RNA라는 언어를 이해하고 조작하여 질병과 싸울 수 있는 방법을 알려주었기 때문입니다.
자주 묻는 질문 ❓
지금까지 카탈린 카리코와 드류 와이스먼의 2008년 기념비적인 논문을 살펴보았습니다. 이 역사적인 논문을 꼼꼼히 뜯어보니 어떠신가요? 단순한 기술적 성취를 넘어, 불가능해 보이던 도전을 가능으로 바꾼 두 과학자의 인내와 통찰이 느껴지지 않나요? "세상은 가끔 미친 생각이라고 비웃던 아이디어에 의해 구원받곤 하죠." 학습 노트를 통해 우리가 배운 것은 명확합니다. 과학의 진보는 거창한 슬로건이 아니라, '슈도유리딘'이라는 아주 작은 분자의 구조적 차이를 파고드는 끈질긴 집념에서 시작된다는 것이죠.

'Tech & Science[기술과 과학] > Matter & Life [물질과 생명]' 카테고리의 다른 글
| 흙수저 이민자에서 백신의 어머니로, 카탈린 카리코의 '돌파의 시간' (7) | 2026.01.14 |
|---|---|
| 루이스 브루스와 양자점(Quantum Dot): 발견부터 QLED 디스플레이까지 (0) | 2026.01.02 |
| 재레드 다이아몬드'제3의 침팬지': 인간과 침팬지의 1.6% 차이가 만든 기적 (2) | 2025.12.25 |
| 세계 최초의 microRNA 조절 경로를 밝힌 1993년 논문: lin-4가 lin-14의 시간을 조절하다 (1) | 2025.12.01 |
| 양자 기술 40년의 시작: 전류 바이어스 조셉슨 접합의 에너지 준위 양자화를 파헤친 1985년 Martinis 논문 (1) | 2025.11.23 |



